Sphäroid-Modelle für Gliome und Kopf-Hals-Tumoren
Unser Projekt befasst sich mit der Etablierung und Weiterentwicklung unterschiedlicher 3D-Modelle zur langfristigen Reduzierung von in-vivo-Mausversuchen in der Erforschung bösartiger Tumoren im Kopf-Hals-Bereich. Langfristig entwickelt die Translationale Strahlenbiologie gezielt und effektiv Sphäroide und Organoide aus Zellkulturen und primären Tumorzellen aus Resektaten, um physiologisch relevante Modelle zu generieren und die Übertragbarkeit der Forschung in die Klinik zu fördern und zu beschleunigen. Kopf-Hals-Tumoren, insbesondere Plattenepithelkarzinome (HNSCC), sind heterogen und an unterschiedlichen Lokalisationen wie Hypopharynx, Larynx, Mundhöhle, Nasopharynx und Oropharynx vertreten. Gliome, die häufigsten Hirntumoren bei Erwachsenen, hingegen sind homogener und werden meist durch Resektion und Radiochemotherapie behandelt. Die Entwicklung moderner, patientenorientierter Therapiestrategien ist herausfordernd, da 2D-Kulturen nur eingeschränkt physiologisch sind und Untersuchungen an primärem Tumorgewebe begrenzt sind. Modelle, die das Immunsystem vollständig abbilden, fehlen, weshalb In-vivo-Mausmodelle weiterhin als Goldstandard gelten. Es besteht daher signifikanter Bedarf an Modellen, die die Tumorstruktur realistisch abbilden, physiologisch sind und nach Möglichkeit auch mit Immunzellen perfundiert werden können, um die Auswirkungen des Immunsystems zu erforschen und die klinische Übertragbarkeit zu verbessern.
Kopf-Hals-Tumorzellen im 3D-Modell Die Generierung und Kultivierung sowohl HPV-negativer als auch HPV-positiver HNSCC-Zelllinien als dreidimensionale Sphäroide erfolgt beispielsweise in Basement-Membrane-Extrakt (BME), einer solubilisierten extrazellulären Matrix (ECM), die aus Englebreth-Holm-Swarm-Maus-Tumorzellen isoliert wird und reich an extrazellulären Matrixproteinen wie Laminin, Kollagen IV, Entaktin und Heparansulfat-Proteoglykanen ist. Mikroskopische Aufnahmen zeigen, dass die ausgesäten Tumorzellen im BME anwachsen, proliferieren und stabile Sphäroide mit durchschnittlichen Durchmessern von 80 – 150 µm bilden (Abb.1).

Abbildung 1: Durchlichtmikroskopische Aufnahmen einer Sphäroid-Kultur von Cal-33 Tumorzellen von der Aussaat bis zum Tag der Ernte (Tag 10). Skala (Tag 1-9): 250 µm. Skala (Tag 10 links): 250 µM, (Tag 10 rechts) 75 µm.
Außerdem sind wir bestrebt, langfristig dreidimensionale Tumoroide aus primärem Tumormaterial herzustellen (Abb.2).
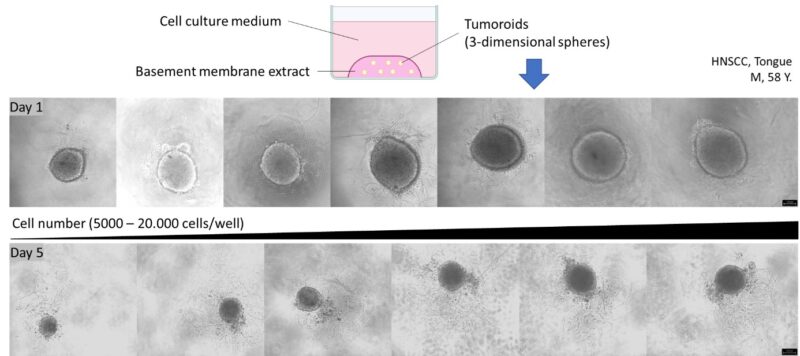
Abbildung 2: Durchlichtmikroskopische Aufnahmen erster 3Dimensionaler Tumoroide aus einer HNSCC Tumorbiopsie. Primäre Tumorzellen werden dabei als Einzelzellsuspension vorbereitet, in 70 %-igem BME resuspendiert und in Gel-Tropen ausgesät. Skala: 120 µm. HNSCC, Head and neck squamous cell carcinoma (Kopf-Hals-Plattenepithelkarzinome).
Neben der Anwendung von BME nutzen wir auch zur Generierung von Sphäroiden aus Tumorzelllinien ultra-low attachtment U-Bottom Plates. Hier entsteht jedes Sphäroid singulär und kann somit auch separat behandelt oder gefärbt werden (z.B. mit CellTiter-Glo® 3D).
Generierung von Sphäroiden aus Glioblastom-Tumorzelllinien
Sphäroide aus Glioblastom weist jedoch erhebliche Unterschiede zwischen humanen und murinen Zelllinien auf. Während die murine GL261-Zelllinie jede der getesteten Methoden für das dreidimensionale Wachstum nutzte (Abb. 3), ermöglichte nur eine spezifische Hydrogel-Zusammensetzung mit spezifischem Laminin-I-Gehalt die Sphäroidbildung humaner Zelllinien. Diese ersten vorläufigen Daten zeigen deutlich, welchen Einfluss die Kultivierungsbedingungen auf das Wachstumsverhalten verschiedener Tumorzelllinien haben und weshalb eine gute Etablierung sowie Charakterisierung der Modelle von Bedeutung sind.

Abbildung 3: Durchlichtmikroskopische Bilder einer Sphäroid-Kultur muriner Glioblastom-Tumorzellen (GL261-luc2) von Tag 3 bis Tag 13 in Low-Attachment U-bottom Plates. Skala: 250 µm.
2. Übersichts-/ Originalartikel
Lilli Zülch, Anna Schäfer, Felix Deckwer, Kirsten Lauber, Rainer Fietkau, Udo Gaipl, Tina Jost. Immunologischer Einfluss einer multimodalen Behandlung aus Kinase Inhibitoren und hypofraktionierter RT auf die dreidimensionale Sphäroid Ko-Kultur aus HNSCC und cytotoxischen T Zellen. DEGRO 2025 Abstractband. Strahlenther Onkol 201 (Suppl 1), 1–215 (2025). https://doi.org/10.1007/s00066-025-02406-y
Deckwer CF, …, Jost T. Etablierung einer 3-dimensionalen Sphäroïdkultur aus HNSCC-Zelllinien zur physiologischeren Analyse der Expression von Immun-Checkpoint-Molekülen nach Strahlentherapie; DEGRO 2024 Abstractband. Strahlenther Onkol 200 (Suppl 1), 1–204 (2024). https://doi.org/10.1007/s00066-024-02233-7
Meidenbauer, J., Wachter, M., Schulz, S. R., Mostafa, N., Zülch, L., Frey, B., Fietkau, R., Gaipl, U. S., & Jost, T. (2024). Inhibition of ATM or ATR in combination with hypo-fractionated radiotherapy leads to a different immunophenotype on transcript and protein level in HNSCC. Frontiers in Oncology, 14, 1460150. https://doi.org/10.3389/fonc.2024.1460150
3. Kontakt:
Dr. Anja Derer, Dr. Tina Jost und PD Dr. Benjamin Frey.
AG Translationale Strahlenbiologie/Strahlenklinik
09131/85-44278, – 44276 oder -44248
Translationale Strahlenbiologie – Strahlenklinik | Uniklinikum Erlangen